
Περιεχόμενο
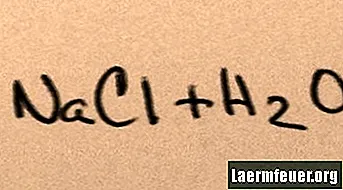
Όταν προστίθεται άλας στο νερό, διαλύεται στα συστατικά του μόρια έως ότου τα μέγιστα ιόντα άλατος που μπορεί να υποστηρίξει το νερό να κυμαίνονται γύρω από τα μόρια υδρογόνου και οξυγόνου. Όταν συμβεί αυτό, η λύση ονομάζεται «κορεσμένη». Όταν διαλύεται περισσότερο αλάτι, τα ιόντα νατρίου και χλωριδίου συγκρούονται μεταξύ τους και ανασυνδυάζονται σε κρυστάλλους αλατιού. Αυτό το φαινόμενο είναι γνωστό ως "καθίζηση", επειδή το σχηματισμένο στερεό πέφτει στον πυθμένα του νερού. Τα άλατα είναι "υδρόφιλα", δηλαδή έλκονται από το νερό. Αυτό το αξιοθέατο διευκολύνει μια οικεία μορφή υετού: οι σταγόνες βροχής σχηματίζονται γύρω από μικροσκοπικούς κρυστάλλους αλατιού στα σύννεφα, καθιστώντας το ελαφρώς αλμυρό.
Το βασικό

Ηλεκτρολύτες

Το αλάτι δεν μεταφέρει ηλεκτρισμό σε στερεά κατάσταση, αλλά σε ρευστή (υγρή) κατάσταση σχηματίζει μια λύση που μπορεί να αγωγεί ηλεκτρισμό πολύ καλά. Η αγωγιμότητα εξαρτάται από τον τύπο του χρησιμοποιούμενου άλατος, αλλά αυτά τα υγρά, που ονομάζονται διαλύματα ηλεκτρολυτών, είναι εξαιρετικοί φορείς ενώσεων που απαιτούνται από το ανθρώπινο σώμα. Οι ηλεκτρικές παρορμήσεις που δημιουργούνται από τον εγκέφαλο παράγουν ελεύθερο οξυγόνο, το οποίο χρησιμοποιείται από το αίμα. Τα μόρια άλατος ταξινομούνται σε ηλεκτρολύτες (νάτριο, κάλιο ή ασβέστιο) και χλωριούχα σε διάλυμα: το χλωρίδιο αντλείται από το αίμα και τα νεφρά στα ούρα και οι ηλεκτρολύτες κατανέμονται μέσω του νευρομυϊκού συστήματος σε μια διαδικασία που καλούν οι αθλητές ενυδάτωση.
Συνεργατικές ιδιότητες

Οποιοδήποτε διάλυμα διαφέρει από την αρχική του σύνθεση επειδή η προσθήκη μορίων, ακόμη και όταν δεν σχηματίζουν νέες ενώσεις, αλλάζει το μοριακό βάρος του υγρού και επηρεάζει τις ιδιότητές του. Το αλμυρό νερό είναι πυκνότερο από το καθαρό νερό και επίσης παγώνει πιο αργά. Καθώς παγώνει, ωστόσο, το αλάτι μεταναστεύει στα όρια του υγρού, καθιστώντας το βαρύτερο και πιο κορεσμένο και στη συνέχεια μειώνοντας το σημείο πήξης του. Στο άλλο άκρο της κατάστασης της ύλης, όσο πιο πυκνό είναι το αλμυρό νερό, τόσο περισσότερη θερμότητα απαιτείται για να εξατμιστεί, έως ότου τελειώσει το νερό, αφήνοντας ένα στρώμα αλατιού. Οι μάγειρες περιμένουν το νερό στο δοχείο να βράσει για να προσθέσει αλάτι, ώστε να μην καθυστερήσει η θέρμανση. Αυτές οι ιδιότητες, γνωστές ως «συνεργικές ιδιότητες», βοηθούν τους επιστήμονες να προσδιορίσουν το μοριακό βάρος του αλμυρού νερού. Εάν μπορεί να μετρηθεί η μάζα, η ατμοσφαιρική πίεση και το σημείο βρασμού του υγρού, τότε οι επιστήμονες μπορούν να αφαιρέσουν το μοριακό βάρος του νερού για να ανακαλύψουν ποια άλατα υπάρχουν.