Περιεχόμενο
- Οδηγίες
- Αριθμός ηλεκτρονίων στο στρώμα σθένους
- Δομή Lewis
- Τυπική φόρτιση κάθε ατόμου
- Ανακοίνωση
- Τι χρειάζεστε
Κατά τον προσδιορισμό του τυπικού φορτίου ενός μορίου όπως το CoCl2 (αέριο φωσγενίου), είναι απαραίτητο να γνωρίζουμε τον αριθμό των ηλεκτρονίων στο στρώμα σθένους κάθε ατόμου και τη δομή Lewis του μορίου.
Οδηγίες

-
Αναζητήστε κάθε άτομο στο περιοδικό πίνακα των στοιχείων για να προσδιορίσετε τον αριθμό των ηλεκτρονίων στο στρώμα σθένους.
-
Θυμηθείτε ότι δύο ηλεκτρόνια βρίσκονται στο πρώτο υπο-επίπεδο s, δύο είναι στο δεύτερο υπο-επίπεδο s, έξι ηλεκτρόνια στο πρώτο υπο-επίπεδο p και ούτω καθεξής. Ανάκληση: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6).
-
Χτυπήστε το φορτίο. Εάν το μόριο είναι ένα ιόν, προσθέστε ή αφαιρέστε ένα ή περισσότερα ηλεκτρόνια από το σύνολο για να φτάσετε στο τελικό φορτίο.
-
Για το CoCl2 (αέριο φωσγενίου): C = 4; Ο = 6; Cl = 7. Το μόριο δεν είναι ιονισμένο και έχει ουδέτερο φορτίο. Επομένως, ο συνολικός αριθμός ηλεκτρονίων στο στρώμα σθένους είναι 4 + 6 + (7x2) = 24.
Αριθμός ηλεκτρονίων στο στρώμα σθένους
-
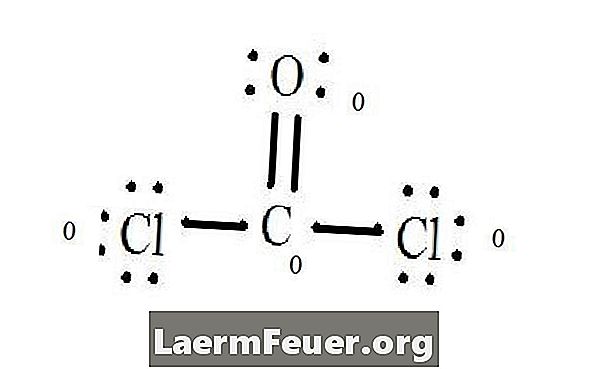
Δείτε το διάγραμμα κατασκευής Lewis του CoCl2 (αέριο φωσγενίου). Η δομή Lewis αντιπροσωπεύει την πλέον σταθερή και πιθανή δομή για το μόριο. Τα άτομα σχηματίζονται με ζευγαρωμένα ηλεκτρόνια σθένους. σχηματίζονται δεσμοί μεταξύ των ελεύθερων ηλεκτρονίων για να ικανοποιηθεί ο κανόνας των οκτάδων.
-
Σχεδιάστε κάθε άτομο και τα ηλεκτρόνια σθένους του και στη συνέχεια σχηματίστε δεσμούς όπως απαιτείται.
Ηλεκτρονίων που αντλούνται από τη δομή Lewis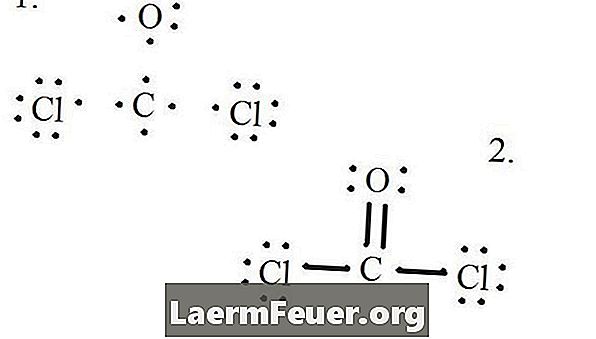
-
Τα άτομα χλωρίου μοιράζονται απλούς δεσμούς με το μόριο άνθρακα, ενώ το άτομο οξυγόνου σχηματίζει διπλό δεσμό με άνθρακα. Κάθε άτομο στην τελική δομή ικανοποιεί τον κανόνα των οκτάδων και έχει οκτώ ηλεκτρόνια στο στρώμα σθένους, επιτρέποντας τη μοριακή σταθερότητα.
Δομή Lewis
-
Μετρήστε τα ελεύθερα ζεύγη ηλεκτρονίων κάθε ατόμου στη δομή Lewis. Κάθε άτομο δηλώνει ένα ηλεκτρόνιο από κάθε δεσμό από το οποίο συμμετέχει. Προσθέστε αυτούς τους αριθμούς. Σε CoCl2: C = 0 ελεύθερα ζευγάρια συν 4 ηλεκτρόνια δεσμού = 4 ηλεκτρόνια. Ο = 4 ηλεκτρόνια των ελεύθερων ζευγών συν 2 ηλεκτρόνια των δεσμών = 6 ηλεκτρόνια. Cl = 6 ηλεκτρόνια ελεύθερων ζευγών συν ένα ηλεκτρόνιο ενός δεσμού με C = 7 ηλεκτρόνια.
-
Αφαιρέστε την ποσότητα του αριθμού των ηλεκτρονίων στο στρώμα σθένους στο μη συνδεδεμένο άτομο. Το αποτέλεσμα είναι η επίσημη φόρτιση για κάθε άτομο. Στα ηλεκτρόδια σθένους CoCl2: C = 4 (ev) στο μη συνδεδεμένο άτομο μείον 4 ηλεκτρόνια που ορίζονται στη δομή Lewis (LS) = 0 τυπικό φορτίο O = 6 ev - 6 LS = 0 τυπικό φορτίο Cl = 7 και - 7 LS = 0 επίσημο τέλος
Τυπικές κατηγορίες ατόμων
-
Όταν γράφετε, τοποθετήστε αυτές τις χρεώσεις κοντά στα άτομα στη δομή του Lewis. Εάν συνολικά το μόριο έχει ένα φορτίο, τοποθετήστε τη δομή Lewis σε παρενθέσεις με τη φόρτιση που έχει εγγραφεί στο εξωτερικό στην επάνω δεξιά γωνία.
Τυπική φόρτιση κάθε ατόμου
Ανακοίνωση
- Ο υπολογισμός του επίσημου φορτίου για μόρια που περιέχουν μεταβατικά μέταλλα μπορεί να είναι προκλητικός. Ο αριθμός των ηλεκτρονίων στο στρώμα σθένους για μεταβατικά μέταλλα θα είναι εκείνοι από το σχέδιο ευγενών αερίων.
Τι χρειάζεστε
- Περιοδικός πίνακας των στοιχείων